版權歸原作者所有,如有侵權,請聯係我們(men)
線粒體(ti) (Mitochondrion),是一種存在於(yu) 大多數真核生物細胞中的半自主細胞器,其中含有有限的遺傳(chuan) 物質,也是細胞中製造能量,為(wei) 細胞提供動力的場所。除此之外,線粒體(ti) 還參與(yu) 到諸如細胞分化、細胞間信息傳(chuan) 遞和細胞凋亡等生理過程,對於(yu) 我們(men) 體(ti) 內(nei) 各種細胞行使正常生理功能至關(guan) 重要。線粒體(ti) 的結構由外到內(nei) 主要可分為(wei) 外膜、膜間隙、內(nei) 膜、線粒體(ti) 脊(是線粒體(ti) 內(nei) 膜向線粒體(ti) 基質折褶形成的一種結構。線粒體(ti) 脊的形成增大了線粒體(ti) 內(nei) 膜的表麵積)和線粒體(ti) 基質(圖1)。
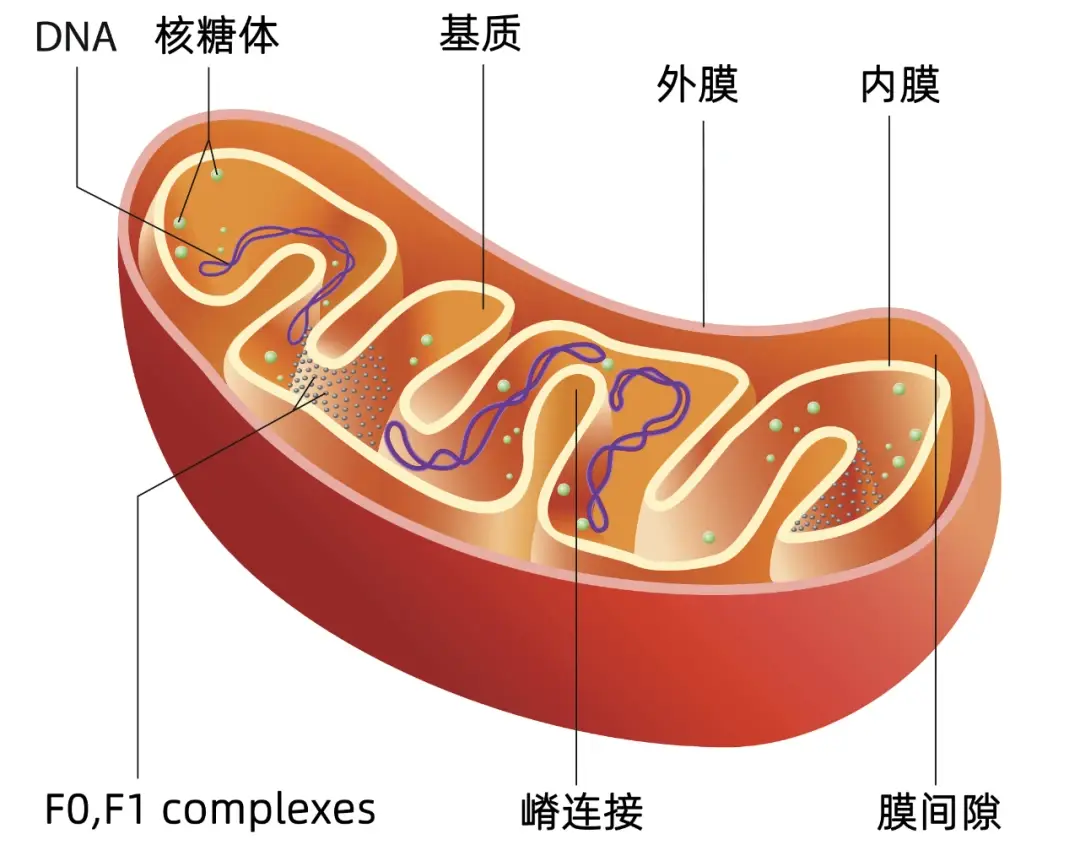
圖1 線粒體(ti) 結構
衰老,是我們(men) 每個(ge) 人都不可避免的一個(ge) 過程。在衰老的過程中,大腦結構會(hui) 發生難以逆轉的退行性改變,如大腦皮層的體(ti) 積縮小,這種結構改變毫無疑問會(hui) 影響到大腦正常功能的運作,體(ti) 現在我們(men) 的日常生活中,如反應能力的下降、運動的遲緩或者心理情緒的變化等。同樣,隨著衰老的發生,存在於(yu) 我們(men) 每個(ge) 細胞中的線粒體(ti) 結構也會(hui) 發生改變,包括線粒體(ti) 脊逐漸回縮到線粒體(ti) 內(nei) 膜上、線粒體(ti) 基質碎片化、線粒體(ti) 內(nei) 膜形成囊泡狀結構和內(nei) 膜上二聚體(ti) 結構的ATP酶解聚為(wei) 單體(ti) ,最終外膜破裂,將細胞凋亡因子釋放到細胞質中,導致細胞死亡[1]。然而,因衰老導致的這些線粒體(ti) 結構異常變化的分子機製尚未清楚。
近日,中國科學技術大學劉強團隊在 Cell Metabolism 期刊上發表了題為(wei) Aging-induced tRNAGlu-derived fragment impairs glutamate biosesynthesis by targeting mitochondrial translation-dependent cristae organization 的研究論文[2],發現衰老大腦的穀氨酸能神經元細胞核所釋放的穀氨酸轉運RNA(tRNAGlu),會(hui) 被剪切成微小RNA片段(transfer-RNAderived small RNA,tsRNA)—— Glu-5’tsRNA-CTC並聚集在線粒體(ti) 中,因此打斷了線粒體(ti) 亮氨酸轉運RNA(mt-tRNALeu)和亮氨酸轉運RNA合成酶2(Leucyl-tRNA synthetase2,LaRs2)的結合,損害了線粒體(ti) 亮氨酸轉運RNA的氨基酰化和線粒體(ti) 編碼蛋白質的翻譯過程。並且,Glu-5’tsRNA-CTC的聚集也會(hui) 導致線粒體(ti) 脊結構改變,穀氨酰胺酶(Glutaminase,GLS)依賴的穀氨酸合成過程受損,降低了突觸間穀氨酸的含量,導致衰老相關(guan) 表征出現,如記憶衰退。此外,本研究除了揭示了線粒體(ti) 超微結構對於(yu) 維持生理狀態下穀氨酸穩態的重要性,也發現了轉運RNA來源的微小RNA片段在衰老及衰老相關(guan) 疾病中的病理作用。
研究團隊首先通過RNA測序發現,相較於(yu) 年輕小鼠,衰老小鼠大腦中Glu-5’tsRNA-CTC明顯增多,並且Glu-5’tsRNA-CTC的增多是由血管生成素(Angiogenin,ANG,一種RNA酶A家族的核糖核酸酶,負責剪切轉運RNA)造成的。年輕時的血管生成素主要以磷酸化的形態分布在細胞核中,隨著衰老的發生,血管生成素逐漸發生去磷酸化,並逐漸分布在細胞質中對轉運RNA進行剪切,導致大量微小RNA片段產(chan) 生。值得一提的是,血管生成素上的絲(si) 氨酸28位點(Ser28)正是介導血管生成素磷酸化的位點。
通過標誌物染色實驗,研究團隊發現Glu-5’tsRNA-CTC聚集在神經元的線粒體(ti) 中,在仔細比較了線粒體(ti) 各結構中Glu-5’tsRNA-CTC的含量後,確定Glu-5’tsRNA-CTC主要集中在線粒體(ti) 基質中。令人驚奇的是,線粒體(ti) 中完全沒有血管生成素的存在,這說明Glu-5’tsRNA-CTC肯定是通過別的方式進入到線粒體(ti) 中的,而不是直接在線粒體(ti) 中被剪切而成。RNA探針和質譜分析給出了答案,在細胞質中合成的亮氨酸轉運RNA合成酶2正是結合Glu-5’tsRNA-CTC幫助其進入線粒體(ti) 的“幫凶”,亮氨酸轉運RNA合成酶2結合到Glu-5’tsRNA-CTC的UUA位點後,Glu-5’tsRNA-CTC借助亮氨酸轉運RNA合成酶2被線粒體(ti) 吞入到線粒體(ti) 基質中。然而這種結合卻阻止了亮氨酸轉運RNA合成酶2與(yu) 它原本的“同伴”——線粒體(ti) 亮氨酸轉運RNA,因為(wei) Glu-5’tsRNA-CTC提前霸占了結合位點,使得線粒體(ti) 亮氨酸轉運RNA無法正常氨基酰化(圖2)。
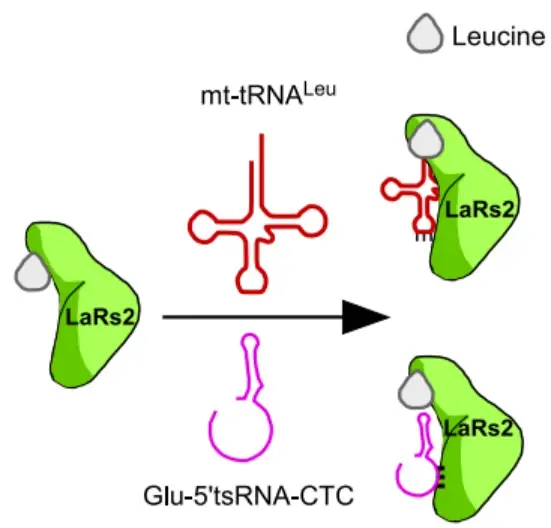
圖2 Glu-5’tsRNA-CTC和線粒體(ti) 亮氨酸轉運RNA競爭(zheng) 結合示意圖
亮氨酸存在於(yu) 眾(zhong) 多線粒體(ti) 基因組編碼的蛋白質中,由於(yu) Glu-5’tsRNA-CTC的幹擾,使得亮氨酸無法正常氨基酰化,導致線粒體(ti) 蛋白質無法正常翻譯產(chan) 生。在前文也提到了,隨著衰老的過程,線粒體(ti) 脊會(hui) 逐漸回縮到線粒體(ti) 內(nei) 膜上,利用Glu-5’tsRNA-CTC敲除小鼠和透射電子顯微鏡(transmission electron microscopy,TEM),研究團隊發現,線粒體(ti) 脊的回縮正是由於(yu) Glu-5’tsRNA-CTC引起線粒體(ti) 蛋白質無法正常翻譯導致的。而這最終也導致了線粒體(ti) 功能受到影響。
穀氨酸是神經元間信號傳(chuan) 導最常見的一類興(xing) 奮性神經遞質,從(cong) 突觸前膜釋放,被突觸後膜上的穀氨酸受體(ti) 識別激活下遊信號。而突觸前膜中穀氨酸的合成過程中最後一環便是由穀氨酰胺酶催化穀氨酰胺轉變為(wei) 穀氨酸,而穀氨酰胺酶便是定位在線粒體(ti) 脊上。因此,當衰老最終導致線粒體(ti) 脊結構異常後,使得穀氨酰胺酶的泛素化程度增加,導致大量穀氨酰胺酶被降解而含量下降,最終使得突觸間的穀氨酸含量下降,使得小鼠的記憶能力也顯著下降。以上結果除了直接說明Glu-5’tsRNA-CTC的升高與(yu) 衰老導致的記憶缺陷有直接關(guan) 聯,也提示了降低Glu-5’tsRNA-CTC的含量可以保護衰老小鼠免受線粒體(ti) 功能障礙,穀氨酸代謝障礙和記憶功能障礙的影響(圖3)。

圖3 Glu-5’tsRNA-CTC病理作用示意圖
除了在小鼠上進行一係列研究外,研究團隊也在老年靈長類動物(恒河猴和人類)大腦中發現了Glu-5’tsRNA-CTC的含量上升。這些現象更進一步提示了Glu-5’tsRNA-CTC可能就是一個(ge) 治療衰老相關(guan) 記憶障礙的潛在靶點。因此,研究團隊設計了針對Glu-5’tsRNA-CTC的反義(yi) 寡核苷酸(antisense oligonucleotide,ASO)來進行治療。反義(yi) 寡核苷酸是一種化學合成的寡核苷酸,通常長度為(wei) 12-30個(ge) 核苷酸,能夠通過堿基配對規則與(yu) 目標RNA進行配對結合,從(cong) 而促使目標RNA進行降解或斷裂,或占據住目標RNA的結合位點,使其無法正常翻譯,從(cong) 而起到抑製作用。研究團隊成功利用Glu-5’tsRNA-CTC反義(yi) 寡核苷酸在小鼠上起到了理想的治療效果。當然,盡管研究團隊在Glu-5’tsRNA-CTC這個(ge) 轉運RNA來源的微小RNA片段研究上取得了重大的突破,但實際上細胞中的微小RNA片段還有許多,不排除其它微小RNA片段也在生理或病理狀態起著重要作用,也許在未來多種微小RNA片段的反義(yi) 寡核苷酸聯用不失為(wei) 一種較好的治療手段。
參考文獻:
[1] Daum B, Walter A, Horst A, Osiewacz HD, Kühlbrandt W. Age-dependent dissociation of ATP synthase dimers and loss of inner-membrane cristae in mitochondria. Proc Natl Acad Sci U S A. 2013 Sep 17;110(38):15301-6. doi: 10.1073/pnas.1305462110. Epub 2013 Sep 4. PMID: 24006361; PMCID: PMC3780843.
[2] Li D, Gao X, Ma X, Wang M, Cheng C, Xue T, Gao F, Shen Y, Zhang J, Liu Q. Aging-induced tRNAGlu-derived fragment impairs glutamate biosesynthesis by targeting mitochondrial translation-dependent cristae organization. Cell Metab. 2024 Mar 1:S1550-4131(24)00057-3. doi: 10.1016/j.cmet.2024.02.011. Epub ahead of print. PMID: 38458203.
歡迎掃碼關(guan) 注深i科普!
我們(men) 將定期推出
公益、免費、優(you) 惠的科普活動和科普好物!



- 參加最新科普活動
- 認識科普小朋友
- 成為科學小記者
 會員登錄
會員登錄














 深圳市龍華區玉翠社區高坳新村小廣場
深圳市龍華區玉翠社區高坳新村小廣場












